Akumulatora darbības princips
Kā darbojas sienas pulkstenis, televizora tālvadības pults vai radio vadāma bērnu rotaļlieta? Lielākā daļa cilvēku bez vilcināšanās atbildēs “no baterijām”, un principā viņiem būs taisnība. Bet diez vai kāds no viņiem spēs pateikt, kā tieši portatīvais akumulators ir trīskāršots, kā tas funkcionē un bez kā nebūtu iespējams viss elektriskās strāvas pārvades process no akumulatora līdz gala patērētājam. Aizpildīsim šo kaitinošo zināšanu robu.
Raksta saturs
Akumulatora darbības princips
Lai izprastu parastā AA akumulatora darbības principu, ir nepieciešama vispārēja izpratne par tā uzbūvi. Tātad, jebkurš akumulators sastāv no trim galvenajiem elementiem - anoda, katoda un elektrolīta. Turklāt pēdējam var būt praktiski jebkurš agregācijas stāvoklis: katods un anods, kas ievietots sāls šķīdumā, principā ir arī “akumulators”, tikai tādā formā, kas ir neparasts vidusmēra cilvēkam.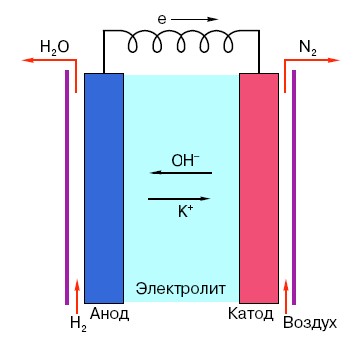
Interesanti! Alesandro Volta izgudrotajā tā sauktajā “volta kolonnā” bija arī visi elementi, kas nepieciešami elektriskās strāvas ražošanai. Tas sastāvēja no viena virs otras saliktām cinka un vara plāksnēm, starp kurām kā “slānis” tika novietots skābē samērcēts audums.
Anods šādās sistēmās ir galvenais elektronu avots, kam, kā zināms no skolas fizikas kursa, ir negatīvs lādiņš.Negatīvi lādētas daļiņas tiek piesaistītas pozitīvajām, un šajā gadījumā katoda virsma darbojas kā “pluss”.
Bet ar to nepietiek, lai notiktu elektriskā strāva, jo elektroniem ir nepieciešama arī sava veida "maģistrāle" - vide, kas atbalstītu katoda un anoda mijiedarbību. Tieši šeit “uz skatuves” parādās elektrolīts - sāls, sārms vai skābe, kas spēj vadīt strāvu.
Apskatīsim darbības principu, izmantojot konkrētu piemēru: ir 18 voltu akumulators. Spriegums starp tajā esošajiem elektrodiem ir stabils, līdz tas ir savienots ar tīklu. Tiklīdz parādās patērētājs (piemēram, parasta spuldze), spriegums sāk pakāpeniski samazināties, strāva sāk plūst no “negatīvā” elektroda uz “pozitīvo”, un elektrolītā notiek ķīmiska reakcija, kuras mērķis ir saglabājot potenciālu starpību starp elektrodiem.
Atsauce. Jo vairāk enerģijas patērētājam ir nepieciešams, jo intensīvāka ir reakcija akumulatora iekšpusē un jo ātrāk tas neizdosies.
Kā darbojas uzlādējams akumulators, kā tas atšķiras no parastā
Tātad, esam apskatījuši klasiskās “pirkstiņa” un “mazā pirkstiņa” baterijas un zinām, ka vairumam no tiem kalpošanas laiks ir stingri ierobežots (lai ko teiktu slaveni ražotāji). Bet kā ir ar tā sauktajām baterijām – bateriju tipa baterijām, kas reakcijas procesā spēj ne tikai patērēt enerģiju, bet arī to uzkrāt un ilgstoši uzglabāt?
Lai saprastu akumulatora darbības principu, ir nepieciešams pievērsties ķīmijai. Ņemsim par piemēru... Parasta ogļu uguni.Neatkarīgi no tā, cik skaista un aizraujoša izskatās liesma, jebkurš ķīmiķis, kas to novēro, zina, ka šis process ir tikai ilgstoša degvielas oksidēšanās reakcija. Degošās ogles mijiedarbojas ar skābekli un šīs reakcijas rezultātā iegūstam:
- oglekļa dioksīds;
- gaisma;
- silts.
Un, ja pēdējie divi punkti spēj sasildīt dvēseli un ķermeni, tad mēs nekādi nevaram izmantot ogļskābo gāzi, jo tas ir reakcijas blakusprodukts, kas patiesībā ir tā atkritumi. Oksidācijas reakcija apstājas, kad beidzas sākuma elementi: skābeklis un ogles. Reakcijas apturēšana akumulatorā notiek tieši tādā pašā veidā, kad sākumvielas ir pilnībā izsmeltas un paliek tikai “atkritumi”.
Akumulatorā viss notiek nedaudz savādāk. Fakts ir tāds, ka tajā notiekošā reakcija pieder pie atgriezeniskas kategorijas, tas ir, noteiktos apstākļos to var “apgriezt”, atgriežot visas vielas sākotnējā stāvoklī. Tā ir iespēja, ka akumulatorā var notikt atgriezeniska reakcija, kas ļauj to uzlādēt.
Tīklam pievienotā akumulatorā reakcija notiek pretējā virzienā, un strāva plūst no “plus” uz “mīnusu”, nevis otrādi. Rezultātā reakcijas produkts veido izejvielas, un akumulatora īpašnieks saņem pieejamo “atkopto” enerģiju portatīvā formātā. Tas ir viss!





